TUMOR MIOFIBROBLÁSTICO INFLAMATORIO DE LOCALIZACIÓN GÁSTRICA, REPORTE DE CASO
TUMOR MIOFIBROBLÁSTICO INFLAMATORIO DE LOCALIZACIÓN GÁSTRICA, REPORTE DE CASO CON ÉNFASIS EN SUS CARACTERÍSTICAS CLÍNICO-PATOLÓGICAS.
Dr. Pablo Ortega Espinosa*, Dr. Hernán
Garrido Cisneros**, Dr. Luis Jaramillo***, Dr. Romel
Ortega Herrera ****.
* Médico especialista en Anatomía Patológica, Laboratorio
de Patología Ortega, Loja-Ecuador
**Médico especialista en cirugía oncológica,
Medihospital, Loja-Ecuador.
***Médico especialista en Gastroenterología,
Medihospital, Loja-Ecuador.
****Médico especialista en Anatomía Patológica, Laboratorio de Patología Ortega, Loja-Ecuador.
RESUMEN:
El tumor miofibroblástico inflamatorio es una
neoplasia poco común en el estómago; a menudo se diagnostica en niños y adultos
jóvenes. Aunque en la mayoría de los casos se comporta de forma benigna, en
casos raros puede dar metástasis. El diagnóstico es complejo, y puede ser confundido
con el tumor estromal gastrointestinal. A continuación, presentamos un caso de
una mujer de 43 años, con tumor gástrico grande que fue extirpado quirúrgicamente
en su totalidad, y cuyo diagnóstico final se basó en sus características
clínicas, histopatológicas e inmunohistoquímicas.
Palabras clave: tumor miofibroblástico inflamatorio, estómago, inmunohistoquímica.
ABSTRACT:
Inflammatory
myofibroblastic tumor is an uncommon neoplasm of the stomach; it is often
diagnosed in children and young adults. Although in most cases it behaves
benign, in rare cases it can metastasize. The diagnosis is complex, and it can
be confused with gastrointestinal stromal tumor. Here we present a case of a
43-year-old woman with a large gastric tumor that was completely removed
surgically and whose final diagnosis was based on clinical, histopathologic and
immunohistochemical features.
Keywords: Inflammatory
myofibroblastic tumor, stomach, immunohistochemistry.
E-mail: portega@ortegalab.com
ORCID ID: 0000-0001-6855-8252
INTRODUCCIÓN:
El tumor miofibroblástico inflamatorio (TMI) es una
neoplasia de potencial biológico intermedio que frecuentemente recurre y raramente
puede dar metástasis. Es una neoplasia rara, se caracteriza por
proliferación de células mesenquimales miofibroblásticas fusiformes acompañada de
infiltrado inflamatorio de células plasmáticas, linfocitos, y eosinófilos.
Aunque estos tumores ocurren principalmente en el pulmón, y partes blandas en
niños, en años recientes se han descrito en múltiples vísceras y afectando a un
amplio rango de edad. Se ha descrito el TMI
en el tracto gastrointestinal, siendo la afectación gástrica extremadamente rara . En el presente trabajo, reportamos un caso de TMI en
una mujer adulta que se presentó como una lesión polipoide gástrica de 6 cm,
que luego de ser operada se pudo llegar al diagnóstico basado en las características
clínicas, histopatológicas e inmunohistoquímicas del tumor.
CASO CLÍNICO:
Paciente de 43 años femenina, multigestante, sin
antecedentes clínicos importantes, antecedentes quirúrgicos de apendicectomía,
colecistectomía, ligadura de trompas y abdominoplastia; quien consulta por
cuadro de sangrado digestivo alto caracterizado por haber presentado desde hace
3 meses anorexia, molestias abdominales vagas.
Desde hace un mes presenta dolor abdominal que se exacerba en la
madrugada, melenas y lipotimia por lo que es hospitalizada para estudio. A su ingreso afebril, hemodinámicamente
estable (PA: 150/90, P: 94, Sat O2: 91%), pálida, bien hidratada, ventila sin
problema, en abdomen: no hay masas palpables, al tacto rectal se evidenció
guante manchado de sangre negruzca.
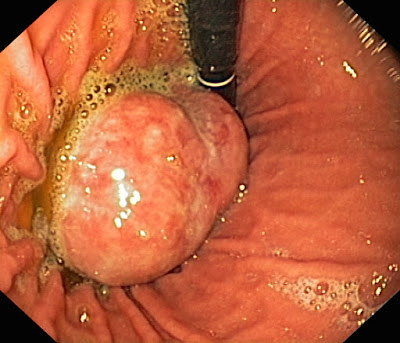
La endoscopia reportó distensibilidad y movilidad
conservada, en cuerpo gástrico, por la curvatura mayor hacia cara posterior, se
encontró tumoración polipoide de 6 cm de diámetro (imagen 1) de aspecto infiltrativo,
sólida, bien delimitada con superficie lisa, con cierta rigidez en la base, que
sangra con facilidad, presentó una zona circundante nodular gruesa de la cual
se procedió a realizar la biopsia, la cual reportó una lesión adenomatosa
tubular benigna, sin embargo, la muestra no fue representativa del tumor.
La tomografía simple y contrastada de abdomen mostró masa sólida bien delimitada, dependiente de la
curvatura mayor, midió 7 cm en sentido anteroposterior, 5.2 cm en sentido
craneocaudal y 4.5 cm en sentido transversal (imagen 2), que provocaba retracción de la
pared gástrica, lo que alteraba su contorno y provocaba pérdida de planos de
clivaje con la pared gástrica, sin embargo, no se evidenció extensión hacia la cavidad
peritoneal.
Con este diagnóstico la paciente fue sometida a
intervención quirúrgica, se realizó inicialmente una gastrectomía subtotal con
estudio transoperatorio que reportó “tumor negativo para malignidad, compatible
con tumor estromal gastrointestinal”. Sin embargo, los bordes quirúrgicos
estaban cercanos al límite de resección quirúrgica, por tal motivo se decide
ampliar la cirugía a una gastrectomía casi total debido a la localización tumoral
alta en cuerpo gástrico, curvatura mayor.
Cinco días más tarde la paciente es dada de alta sin complicaciones.
En el laboratorio de patología se recibió para estudio transoperatorio pieza de resección quirúrgica de aspecto polipoide con base ancha, que midió mide 6 x 5 x 4,5 cm, cubierta por mucosa de color rosado blanquecino, brillante. El tumor estaba a 0.5 cm del límite de resección quirúrgica. Al corte, la consistencia del tumor fue firme, y su superficie interna mostró un tumor sólido con superficie de corte trabecular de color rosado blanquecino. El resultado de transoperatorio fue "compatible con tumor estromal gastrointestinal".
Imagen 4.- Imagen macroscópica del tumor en la que se observa la superficie interna trabecular café clara brillante muy característica.
En estudio histopatológico definitivo se pudo observar pared correspondiente a cuerpo gástrico con mucosa de aspecto histológico conservado, y por debajo de la misma se reconoció la presencia de neoplasia mesenquimal caracterizada por la presencia de células de predominio fusiformes, que adoptaban un patrón estoriforme o fascicular, con núcleos vesiculosos, nucléolos prominentes y citoplasma alargado (imagen 5). En otras áreas las células tumorales presentaron mayor tamaño, con citoplasma amplio, de aspecto epitelioide, algunas con pleomorfismo nuclear moderado, y otras multinucleadas (imagen 6 y 7). El estroma mostró edema, ocasionales vasos sanguíneos hemangiopericíticos, e infiltrado inflamatorio linfoplasmocitario prominente, acompañado de histiocitos, PMNs y ocasionales eosinófilos. Se encontró actividad mitótica dispersa (10 x 50 CAP). La neoplasia estromal presentó compromiso transmural subepitelial hasta llegar a la subserosa del órgano, con crecimiento tumoral expansivo (no infiltrativo). No se identificó áreas de necrosis tumoral.
Imagen 8.- Tinción de inmunohistoquímica muestra positividad focal para desmina.
Las tinciones de inmunohistoquímica mostraron fuerte positividad citoplasmática y nuclear para la vimentina y ciclina D1, respectivamente. Además, positividad focal para la citoqueratina coctel, desmina (imagen 8) y CD10. Las tinciones para CD117, CD34, ALK, AML fueron negativas. Los hallazgos histológicos y de inmunohistoquímica fueron concluyentes con “tumor miofibroblástico inflamatorio”.
DISCUSIÓN:
El TMI fue descripto inicialmente por Siemens en 1921 (11) y desde entonces ha recibido una gran variedad de nombres tales como; fibrosarcoma inflamatorio, pseudotumor inflamatorio o granuloma de células plasmáticas (12–14).
El TMI fue originalmente reportado en el pulmón, pero ha sido reconocido en una variedad de sitios extrapulmonares tales como la piel, órbita, mucosa gingival, glándula mamaria, tiroides, timo, bazo, ganglios linfáticos, lengua, hígado, vesícula biliar, glándula adrenal, útero, ovario, cerebro, médula espinal, mesenterio, apéndice, y en pocas ocasiones ha sido reportado en el tracto gastrointestinal (3–5,8–10,12,13).El TMF afecta principalmente a niños y adultos jóvenes, pero puede y puede abarcar cualquier rango de edad(1,15,16), como en nuestro caso se presentó en una mujer adulta.
La presentación clínica y las
características patológicas macroscópicas del tumor miofibroblástico inflamatorio
pueden simular una malignidad, sin embargo, estos tumores se comportan de una
forma no agresiva
El TMI es considerado un tumor de malignidad intermedia debido a su tendencia para la recurrencia local, la cual es del 25%
en tumores abdominopélvicos y su rareza en dar metástasis (7).
Aunque la forma más común de presentación clínica de
TMI es una masa de descubrimiento incidental, o puede estar determinada por el
sito de origen y los efectos de masa. Una minoría de casos (15-30%) pueden
estar asociados con síndrome completo o incompleto de fiebre, pérdida de peso,
malestar general, anemia, trombocitosis, hiperglobulinemia, y una elevada
velocidad de eritrosedimentación (1,15). En nuestra paciente,
presentó síntomas caracterizados por anorexia, dolor abdominal, y sangrado digestivo bajo, producto del efecto de masa causado por el
tumor de 6 cm localizado en el cuerpo gástrico.
Durante la última mitad del siglo
XX, se debatía sobre si el TMF era un pseudotumor o una neoplasia y si esta era
benigna o maligna. Con el descubrimiento de aberraciones citogenéricas en el
TMI (14,17,18) y el reconocimiento subsecuente de rearreglos en el gen
ALK localizados en el brazo corto del cromosoma como una aberración recurrente
en el TMI, el concepto de que el TMI es una neoplasia se fue ratificando. Actualmente, el TMI es reconocido
como una neoplasia específica entre la larga categoría descriptiva procesos
inflamatorios esclerosantes y fibrosos. El gen del ALK codifica un receptor de
tirosin kinasa y los rearreglos del gen ALK fueron primeramente documentados en
el linfoma anaplásico de células grandes (19).
La alteración ALK generalmente conduce a la sobreexpresión de la proteína ALK y es detectable por inmunohistoquímica, que típicamente demuestra reactividad citoplásmica en el TMI, y también es detectable por citogenética convencional, FISH y reacción en cadena de la polimerasa con transcriptasa inversa (20). La positividad de la tinción mediante inmunohistoquímica para el ALK está presente en 40-100% de los TMI, dependiendo de la localización anatómica(7,19,21,22). En nuestro caso se realizó análisis de ALK mediante inmunohistoquímica, siendo negativa en las células tumorales.
Desde el punto de vista histopatológico, el TMI está compuesto por
células miofibroblásticas acompañadas de células plasmáticas, linfocitos y
eosinófilos en menor cantidad. Se han descrito tres patrones histológicos básicos en el TMI (1). El patrón
fibromixoide/vascular se caracterizaba por una gran separación de células
fusiformes entre estrelladas y abultadas en un patrón mixoide, edematoso o
delicado estroma fibroso suelto con una red vascular rica más o menos regular y
células inflamatorias. Un patrón estoriforme o fascicular, se caracteriza por
proliferación más compacta de células fusiformes dispuestas en un patrón
fascicular o estoriforme. Los núcleos son alargados con extremos romos. Las
células plasmáticas, algunas con cuerpos de Russell, son el tipo de célula
inflamatoria predominante. Y finalmente un patrón esclerosante en el que se
observa un estroma hipocelular esclerótico hialinizado de moderado a extenso. Una
combinación de los tres patrones histológicos puede estar presente. En nuestro
caso se identificó dos patrones histológicos, el más extenso fue el patrón
estoriforme con prominente infiltrado linfoplasmocitario acompañado de un
patrón fibromixoide focal.
La afectación gástrica por el
tumor miofibroblástico inflamatorio es extremadamente rara, fue descrita por
primera vez en 1970 por Soga y colaboradores (12), aunque ha sido reportado con mayor frecuencia en
pacientes pediátricos o adultos jóvenes, afecta a un grupo de adultos de mayor edad. En nuestro conocimiento, hasta la
actualidad existen menos de 30 casos publicados (3–5,8,9,12,13,15,23).
En cuanto a los diagnósticos diferenciales se
encuentran el tumor del estroma gastrointestinal (GIST), el pólipo fibroso
inflamatorio (PFI), neoplasias de músculo liso, tumor de la vaina nerviosa
periférica, el tumor fibroso solitario (TFS), la fibromatosis y, raramente, el
sarcoma de células dendríticas foliculares (24).
El GIST es el tumor mesenquimatoso más común. Macroscópicamente,
el GIST puede mostrar formación de quistes, hemorragia o necrosis, que solo ocasionalmente
está presente en algunos TMI (25). El GIST suele mostrar proliferación de
células fusiformes. Sin embargo, la variante epitelioide también es bien
conocida. El GIST no suele tener el fondo inflamatorio. Además, algunas células
del GIST tienen vacuolas citoplasmáticas, algo que no se ve en el TMI. Mediante inmunohistoquímica, el GIST es positivo para
la CD117 y DOG1, pero negativo para el ALK, mientras que el TMI muestra un
perfil opuesto. En nuestro caso, el CD117 y CD 34 fueron completamente
negativos en las células tumorales.
Los pólipos fibroides inflamatorios (IFP) son tumores
mesenquimales benignos poco frecuentes de histogénesis poco clara (19). Los IFP suelen ocupar la submucosa; sin
embargo, con frecuencia se extienden a la mucosa suprayacente y ocasionalmente
pueden extenderse transmuralmente. Histológicamente, hay una proliferación de
células estromales fusiformes y estrelladas que tienden a condensarse alrededor
de los vasos sanguíneos para formar manguitos perivasculares, que están
ausentes en los TMI. Tanto el IFP como el TMI tienen un fondo inflamatorio,
pero el fondo inflamatorio en el primero es rico en eosinófilos (9). Las células
estromales de los IFP son sistemáticamente positivas para CD34, fascina y
ciclina D1, pero negativas para ALK. En nuestro caso, el
predominio de infiltrado linfoplasmocitario y no de eosinófilos, ausencia de
maguitos celulares perivascular, y negatividad para el CD34, descartaron el
IFP.
Los tumores de músculo liso incluyendo el leiomioma y
el leiomiosarcoma también pueden ocurrir en el estómago (27). Los leiomiomas
gástricos se caracterizan por la disposición fascicular de células fusiformes
con o sin un citoplasma eosinófilo prominente. Se originan principalmente en la
muscular de la mucosa y pueden ser de tamaño muy pequeño (27) El leiomiosarcoma del estómago es muy raro y
muestra una mayor celularidad, al menos atipia nuclear al menos moderada, y un
aumento de la actividad mitótica Los tumores de músculo liso gástrico no suelen
tener un fondo inflamatorio. Inmunohistoquímicamente, los tumores de músculo
liso son difusamente positivos para
desmina, actina y caldesmón, pero son negativos en el TMI . En el presente caso,
la presencia de infiltrado inflamatorio así como la negatividad para la actina
músculo liso descartan este tipo de tumores.
El schwannoma puede imitar ocasionalmente al TMI. A
diferencia de los schwannomas de otras partes del cuerpo, el schwannoma
gástricos carecen de un empalizamiento nuclear bien definido, cuerpos de Verocay,
células de xantoma y paredes vasculares hialinizadas (28). Típicamente, hay un
agregado linfoide periférico tipo manguito con o sin centros germinales
asociados con el schwannoma gástrico primario (28,29). La tinción para S100
es positiva en todos los schwannomas gástricos, siendo completamente negativa
en nuestro caso.
El tumor fibroso solitario y la fibromatosis son
tumores que afectan a la serosa gástrica o se localizan en el epiplón, el
mesenterio o en el mesenterio, y son extremadamente raros como tumores
intramurales intramural como los TMI (30). La ausencia de
infiltración inflamatoria linfoplasmática prominente, la positividad para CD34
y beta-catenina (fibromatosis) y la negatividad para ALK ayudaron a excluir
estos diagnósticos diferenciales. El
presente caso, si bien se pudo observar vasos hemangiopericíticos, la
localización tumoral fue submucosa transmural y mediante inmunohistoquímica negatividad
para el CD34, descartando así un TFS. La presencia de fibrosis fue mínima en
nuestro caso, por lo que morfológicamente se descartó una fibromatosis.
Por último, un tumor muy poco frecuente en el estómago
que puede tener un fondo inflamatorio es el sarcoma folicular de células
dendríticas (24). Un panel
inmunohistoquímico que incluya CD21, CD23, CD35 y ALK debería permitir
distinguir este tumor del TMI. Sin
embargo, en nuestro caso la ausencia de atipia celular marcada excluyó esta
posibilidad diagnóstica.
Aunque la mayoría de TMI son benignos, requieren resección quirúrgica completa, ya que son propensos a la recurrencia local y a las metástasis en muy raras ocasiones. Sin embargo, las opciones son limitadas para pacientes en los que el tumor es irresecable y/o la enfermedad es avanzada. Existe un reporte de TMI gastrointestinal pequeño que fue tratado a base de antiinflamatorios no esteroidales con resultados satisfactorios (6). En los últimos años se han descubierto genes de fusión en ALK, ROS1 o PDGFRB utilizando secuenciación de próxima generación, lo que sugiere que el TMI es en gran medida una neoplasia impulsada por la fusión de quinasas. El estudio se inició por la espectacular respuesta al inhibidor de ROS1 “crizotinib” en un caso anecdótico de un paciente pediátrico con IMT ALK negativo refractario al tratamiento(31).
Además, se ha descrito que los TMI tienen
una expresión de PD-L1 constitutiva y adaptativa frecuente, la última de las
cuales se cree que predice la respuesta a anti-PD-1. Estos datos apoyan una
mayor investigación sobre el bloqueo de PD-1 / PD-L1 en este tipo de tumores (32). En nuestro caso, por tratarse de un tumor
de gran tamaño, localizado en la parte alta de cuerpo gástrico curvatura mayor,
se prefirió la extirpación quirúrgica completa mediante gastrectomía total.
En resumen, presentamos un caso muy raro, poco descrito en la literatura, haciendo hincapié en sus características clínico-patológicas, diagnósticos diferenciales y la importancia de un completo abordaje multidisciplinario para un correcto diagnóstico y tratamiento. Luego del procedimiento quirúrgico, la paciente tuvo una recuperación satisfactoria y luego de tres meses de seguimiento, hasta la fecha de esta publicación no ha presentado recurrencia tumoral.
CONCLUSIONES:
- El TMI es un tumor estromal que se presenta en pocas ocasiones en el tracto gastrointestinal, siendo la localización gástrica extremadamente rara.
- Se caracteriza por proliferación de células miofibroblásticas fusiformes acompañadas de infiltrado inflamatorio linfoplasmocitario.
- El principal diagnóstico diferencial es el tumor estromal gastrointestinal (GIST).
- La inmunohistoquímica es de gran importancia para establecer el diagnóstico correcto.
BIBLIOGRAFÍA:
2. Wang
S, Chen L, Cao Z, Mao X, Zhang L, Wang B. Inflammatory myofibroblastic tumor of
the lumbar spinal canal: A Case Report with Literature Review. Med (United
States) [Internet]. 2017 Jun 1 [cited 2021 May 28];96(26). Available from:
https://pubmed.ncbi.nlm.nih.gov/28658093/
3. Cheng
B, Yang C, Liu Z, Liu L, Zhou L. Primary gastric inflammatory myofibroblastic
tumor A case report. Med (United States). 2018 Dec 1;97(50).
4. Hayashi
M, Kawakubo H, Mayanagi S, Nakamura R, Suda K, Wada N, et al. Gastric
inflammatory myofibroblastic tumor treated with combined laparoscopic and
endoscopic gastric wedge resection: A case report. World J Surg Oncol. 2018 Aug
8;16(1).
5. Riedel
BD, Wong RC, Ey EH. Gastric inflammatory myofibroblastic tumor (inflammatory
pseudotumor) in infancy: Case report and review of the literature. J Pediatr
Gastroenterol Nutr [Internet]. 1994 [cited 2021 Apr 29];19(4):437–43. Available
from: https://pubmed.ncbi.nlm.nih.gov/7877000/
6. Park
SG, Kim GH, Park HJ, Kahng DH, Lee BE, Park DY. Case of an Inflammatory
Myofibroblastic Tumor of the Duodenum. Korean J Gastroenterol [Internet]. 2018
Jul 25 [cited 2021 May 24];72(1):28–32. Available from:
https://pubmed.ncbi.nlm.nih.gov/30049175/
7. Coffin
CM, Hornick JL, Fletcher CDM. Inflammatory myofibroblastic tumor: Comparison of
clinicopathologic, histologic, and immunohistochemical features including ALK
expression in atypical and aggressive cases. Am J Surg Pathol [Internet]. 2007
Apr [cited 2021 Apr 29];31(4):509–20. Available from:
https://pubmed.ncbi.nlm.nih.gov/17414097/
8. Kim
GH, Park DY. A Rare Cause of Gastric Subepithelial Tumor. Clin Endosc
[Internet]. 2020 May [cited 2021 Apr 29];53(3):377–8. Available from:
http://www.ncbi.nlm.nih.gov/pubmed/32506895
9. Makhlouf
HR, Sobin LH. Inflammatory myofibroblastic tumors (inflammatory pseudotumors)
of the gastrointestinal tract: How closely are they related to inflammatory
fibroid polyps? Hum Pathol [Internet]. 2002 [cited 2021 Apr 29];33(3):307–15.
Available from: https://pubmed.ncbi.nlm.nih.gov/11979371/
10. Primary
gastric inflammatory myofibroblastic tumor: a clinicopathologic and
immunohistochemical study of 5 cases - PubMed [Internet]. [cited 2021 Apr 29].
Available from: https://pubmed.ncbi.nlm.nih.gov/20304564/
11. D: S.
Primary hemangiolymphoma of the hemal nodes: An unusual variety of malignant
tumors. Arch Int Med. 1921;38:467–74.
12. Soga J,
Saito K, Suzuki N, Sakai T. Plasma cell granuloma of the stomach. A report of a
case and review of the literature. Cancer [Internet]. 1970 [cited 2021 Apr
30];25(3):618–25. Available from: https://pubmed.ncbi.nlm.nih.gov/5416828/
13. Tada T,
Wakabayashi T, Kishimoto H. Plasma cell granuloma of the stomach. A report of a
case associated with gastric cancer. Cancer [Internet]. 1984 [cited 2021 Apr
30];54(3):541–4. Available from: https://pubmed.ncbi.nlm.nih.gov/6375856/
14. Treissman
SP, Gillis DA, Lee CL et al. Omental-mesenteric
inflammatory pseudotumor. Cytogenetic demonstration of genetic changes and
monoclonality in one tumor. Cancer. 1994;(73):1433–7.
15. Souid
AK, Ziemba MC, Stephen Dubansky A, Mazur M, Oliphant M, Deaver Thomas F, et al.
Inflammatory myofibroblastic tumor in children. Cancer [Internet]. 1993 [cited
2021 May 21];72(6):2042–8. Available from:
https://pubmed.ncbi.nlm.nih.gov/8364883/
16. RAMACHANDRA
S, HOLLOWOOD K, BISCEGLIA M, FLETCHER CDM. Inflammatory pseudotumour of soft
tissues: a clinicopathological and immunohistochemical analysis of 18 cases.
Histopathology [Internet]. 1995 [cited 2021 May 21];27(4):313–23. Available
from: https://pubmed.ncbi.nlm.nih.gov/8847061/
17. Su LD,
Atayde-Perez A, Sheldon S et al.
Inflammatory myofibroblastic tumor: cytogenetic evidence supporting clonal
origin. Mod Pathol. 1998;11:364–8.
18. Snyder
CS, Dell’Aquila M, Haghighi P et al.
Clonal changes in inflammatory pseudotumor of the lung: a case report. Cancer.
1995;(76):1545–9.
19. Cook
JR, Dehner LP, Collins MH, Ma Z, Morris SW, Coffin CM, et al. Anaplastic
lymphoma kinase (ALK) expression in the inflammatory myofibroblastic tumor: A
comparative immunohistochemical study. Am J Surg Pathol [Internet]. 2001 [cited
2021 Apr 29];25(11):1364–71. Available from:
https://pubmed.ncbi.nlm.nih.gov/11684952/
20. Cessna
MH, Zhou H, Sanger WG, Perkins SL, Tripp S, Pickering D, et al. Expression of
ALK1 and p80 in inflammatory myofibroblastic tumor and its mesenchymal mimics:
A study of 135 cases. Mod Pathol [Internet]. 2002 [cited 2021 May
24];15(9):931–8. Available from: https://pubmed.ncbi.nlm.nih.gov/12218210/
21. Rabban
JT, Zaloudek CJ, Shekitka KM, Tavassoli FA. Inflammatory myofibroblastic tumor
of the uterus: A clinicopathologic study of 6 cases emphasizing distinction
from aggressive mesenchymal tumors. Am J Surg Pathol [Internet]. 2005 Oct
[cited 2021 May 24];29(10):1348–55. Available from:
https://pubmed.ncbi.nlm.nih.gov/16160478/
22. Montgomery
EA, Shuster DD, Burkart AL, Esteban JM, Sgrignoli A, Elwood L, et al.
Inflammatory myofibroblastic tumors of the urinary tract: A clinicopathologic
study of 46 cases, including a malignant example inflammatory fibrosarcoma and
a subset associated with high-grade urothelial carcinoma. Am J Surg Pathol
[Internet]. 2006 Dec [cited 2021 May 24];30(12):1502–12. Available from:
https://pubmed.ncbi.nlm.nih.gov/17122505/
23. Shi H,
Wei L, Sun L, Guo A. Primary gastric inflammatory myofibroblastic tumor: A
clinicopathologic and immunohistochemical study of 5 cases. Pathol Res Pract
[Internet]. 2010 May [cited 2021 May 28];206(5):287–91. Available from:
https://pubmed.ncbi.nlm.nih.gov/20304564/
24. Han JH,
Kim SH, Noh SH, Lee YC, Kim HG, Yang WI. Follicular dendritic cell sarcoma
presenting as a submucosal tumor of the stomach. Arch Pathol Lab Med
[Internet]. 2000 [cited 2021 May 27];124(11):1693–6. Available from:
https://pubmed.ncbi.nlm.nih.gov/11079028/
25. Charville
GW, Longacre TA. Surgical Pathology of Gastrointestinal Stromal Tumors:
Practical Implications of Morphologic and Molecular Heterogeneity for Precision
Medicine [Internet]. Vol. 24, Advances in Anatomic Pathology. Lippincott
Williams and Wilkins; 2017 [cited 2021 May 27]. p. 336–53. Available from:
https://pubmed.ncbi.nlm.nih.gov/28820749/
26. Pantanowitz
L, Antonioli DA, Pinkus GS, Shahsafaei A, Odze RD. Inflammatory Fibroid Polyps
of the Gastrointestinal Tract: Evidence for a Dendritic Cell Origin [Internet].
Vol. 28, American Journal of Surgical Pathology. Am J Surg Pathol; 2004 [cited
2021 May 27]. p. 107–14. Available from:
https://pubmed.ncbi.nlm.nih.gov/14707872/
27. Agaimy
A, Wünsch PH. True smooth muscle neoplasms of the gastrointestinal tract:
Morphological spectrum and classification in a series of 85 cases from a single
institute. Langenbeck’s Arch Surg [Internet]. 2007 Jan [cited 2021 May
27];392(1):75–81. Available from: https://pubmed.ncbi.nlm.nih.gov/17021790/
28. Sánchez-Morales
GE, Trolle-Silva AM, Moctezuma-Velázquez P, Rodríguez-Quintero JH,
Alcazar-Félix RJ. Gastric schwannoma: A rarity among mesenchymal tumors of the
gastrointestinal tract. Rev Gastroenterol Mex [Internet]. 2020 Jan 1 [cited
2021 May 27];85(1):102–4. Available from:
https://pubmed.ncbi.nlm.nih.gov/31427112/
29. Hou YY,
Tan YS, Xu JF, Wang XN, Lu SH, Ji Y, et al. Schwannoma of the gastrointestinal
tract: A clinicopathological, immunohistochemical and ultrastructural study of
33 cases. Histopathology [Internet]. 2006 Apr [cited 2021 May 27];48(5):536–45.
Available from: https://pubmed.ncbi.nlm.nih.gov/16623779/
30. Lee WA,
Lee MK, Jeen YM, Kle JH, Chung JJ, Yun SH. Solitary fibrous tumor arising in
gastric serosa. Pathol Int [Internet]. 2004 Jun [cited 2021 May
27];54(6):436–9. Available from: https://pubmed.ncbi.nlm.nih.gov/15144403/
31. Lovly
CM, Gupta A, Lipson D, Otto G, Brennan T, Chung CT, et al. Inflammatory
myofibroblastic tumors harbor multiple potentially actionable Kinase fusions.
Cancer Discov [Internet]. 2014 [cited 2021 May 30];4(8):889–95. Available from:
https://pubmed.ncbi.nlm.nih.gov/24875859/
32. Cottrell
TR, Duong AT, Gocke CD, Xu H, Ogurtsova A, Taube JM, et al. PD-L1 expression in
inflammatory myofibroblastic tumors. Mod Pathol [Internet]. 2018 Jul 1 [cited
2021 May 30];31(7):1155–63. Available from:
https://pubmed.ncbi.nlm.nih.gov/29449680/









Comentarios
Publicar un comentario